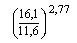|
Российская Ассоциация
(РАМЛД) |
г.Москва, 119526, а/я 117, РАМЛД,
т/ф.: (495) 433-24-04
|
автор: Т.Н. Дугина, А.Б. Косырев ООО «НПО «Медио Лаб», Москва год издания: 2003 |
Стандартизация протромбинового теста: проблема контрольной плазмы.
Введение.
Для профилактики и длительного лечения больных с риском тромбоэмболических заболеваний сегодня наиболее часто используют оральные антикоагулянты (ОА). По данным Baglin [2], в 1998 году варфарин принимал каждый 200-й житель Великобритании. Основным методом лабораторного контроля терапии ОА остается предложенный А. Квиком в 1935 году протромбиновый тест (ПТ) [15]. Его суть заключается в свертывании цитратной плазмы в присутствии тромбопластина и оптимальной концентрации ионов Са. Популярность теста связана с тем, что он отражает снижение большинства витамин К-зависимых прокоагулянтов (факторов II, X, VII), прост в исполнении, легко поддается автоматизации и относительно дешев. Однако различная чувствительность препаратов тромбопластина к вызванным ОА изменениям уровня факторов свертывания обусловливала значительные сложности в оценке результатов ПТ в различных лабораториях. Разрешению проблемы способствовала разработка в 1983 году системы МНО/МИЧ (международное нормализованное отношение/международный индекс чувствительности), позволившей выражать результаты ПТ “тромбопластин-независимым” способом [17]. Результатом внедрения этой системы в клиническую и лабораторную практику стало повышение безопасности лечения ОА и расширение спектра показаний для их использования [5]. Вместе с тем, сегодня уже очевидны недостатки системы МНО/МИЧ. Во-первых, калибровка тромбопластина по чувствительности (сертификация МИЧ) требует международных референсных препаратов, ограниченных в количестве и дорогих, большого количества свежих плазм (20 нормальных и 60 патологических кумариновых) [17]. Во-вторых, калибровка должна осуществляться исключительно вручную, тогда как ПТ в лабораториях автоматизирован, а МИЧ тромбопластина и, следовательно, величина МНО зависят от типа коагулометра [13]. В-третьих, МНО, как нормализованное протромбиновое отношение, определяется так называемым средним нормальным протромбиновым временем, вычисление которого весьма трудоемко [8]. Все вышесказанное заставляет научное сообщество искать иные, более простые подходы к стандартизации ПТ, среди которых ключевое на сегодняшний день значение принадлежит системе так называемой локальной калибровки тромбопластина и коагулометра с помощью лиофилизированных плазм с сертифицированным МНО [10].
Среднее нормальное протромбиновое время
МНО вычисляют по следующей формуле:
 (1)
(1)
где ПВпац — ПВ пациента в с,
СНПВ — среднее нормальное ПВ в с,
МИЧ — международный индекс чувствительности тромбопластина.
Критическим требованием ВОЗ для правильного вычисления МНО является определение СНПВ [8,12,17]. СНПВ представляет собой среднее геометрическое ПВ свежих плазм крови, взятых, как минимум, от 20 здоровых людей. Его вычисляют следующим образом:
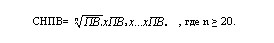
Среднее геометрическое предпочтительнее среднего арифметического, так как минимизирует влияние любого отклонения среди нормальной группы (например, при удлинении ПВ одной или более свежих плазм) [8]. Совершенно очевидно, что сбор большого числа свежих плазм крови затруднителен, особенно для небольших клинико-диагностических лабораторий. Тем не менее необходимо помнить, что для каждой серии тромбопластина лаборатория должна вычислять СНПВ [8].
Фирмы-производители препаратов тромбопластина выпускают лиофилизированные контрольные плазмы, их ПВ часто используют для вычисления МНО. Вопрос заключается в следующем: правомерно ли такое отступление от рекомендаций ВОЗ? Иными словами, эквивалентны ли ПВ лиофилизированных плазм и СНПВ свежих плазм? При лиофилизации к плазме добавляют стабилизаторы, чтобы предотвратить потерю активности лабильных факторов свертывания крови. Влияние таких стабилизаторов на результаты ПТ тщательно исследовано производителями и исследователями-участниками программ контроля качества [9,14,16]. Сделано заключение, что лиофилизированные плазмы не заменяют свежие, поскольку замораживание (необходимый этап лиофильного высушивания), так же как и защитные добавки удлиняют ПВ нормальных и кумариновых плазм, причем степень пролонгирования зависит от типа тромбопластина. Таким образом, для вычисления МНО необходимо определять СНПВ свежих плазм, причем условия должны быть идентичны (включая концентрацию антикоагулянта, систему для взятия крови, коагулометр) тем, в которых будут анализировать плазму пациента, стабилизированного на ОА [8]. Лиофилизированная плазма в случае терапии ОА полезна лишь для оценки качества работы лаборатории, точности измерений и возможных технических проблем при выполнении теста. К сожалению, в Рекомендациях Всероссийской ассоциации по изучению тромбозов, геморрагий и патологии сосудов имени А.А.Шмидта-Б.А.Кудряшова по лечению оральными антьикоагулянтами [1] ошибочно использовано ПВ лиофилизированной нормальной контрольной плазмы для вычисления МНО, что может привести к неправильной оценке терапевтического уровня гипокоагуляции. Действительно, если ПВ контрольной плазмы больше СНПВ, то величины МНО будут меньше фактических, что может привести к передозировке ОА, если же ПВ контрольной плазмы меньше СНПВ, то вычисленное МНО будет больше фактического и приведет к отмене ОА и возрастанию риска тромботических осложнений. Вариации МНО, обусловленные флуктуациями значений ПВ нормальной плазмы в течение рабочего дня, иллюстрирует таблица 1.
Таблица 1. Вариации МНО вследствие флуктуаций ПВ нормальной контрольной плазмы [12].
|
День 1 День 2 День 3 | |||
|
ПВ пациента |
16,1 сек |
16,1 сек |
16,1 сек |
|
ПВ нормальной контрольной плазмы |
11,6 сек |
10,6 сек |
12,6 сек |
|
Формула (МИЧ тромбопластина 2,77) |
|
|
|
|
МНО |
2,5 |
3,18 |
1,97 |
Концентрация антикоагулянта как источник вариабельности МНО.
В литературе хорошо документирована зависимость СНПВ, ПВ пациента и МИЧ тромбопластина от концентрации антикоагулянта, используемого для стабилизации крови [4]. ВОЗ рекомендует использовать цитрат в концентрации 109 мМ [18]. На сегодняшний день все международные стандарты тромбопластина откалиброваны по МИЧ на плазмах крови, взятой со 109 мМ цитратом. Вместе с тем, в рутинной работе для стабилизации крови Великобритания, Австрия, Нидерланды используют 105-109 мМ цитрат, Италия — 129 мМ, США и Япония — обе концентрации [3]. Это одна из главных причин вариабельности системы МНО/МИЧ. В России в качестве антикоагулянта применяют 3,8% цитрат натрия, при этом его молярность неизвестна, так как цитрат натрия — кристаллогидрат, то есть в построении его молекулы участвует вода, причем количество кристаллизационной воды составляет 2 или 5,5 молекул воды на молекулу цитрата. Учитывая изложенное, совершенно очевидно, что необходимо готовить не процентный, а молярный раствор цитрата натрия.
Поскольку концентрация антикоагулянта влияет на ПВ пациента, СНПВ, и МИЧ тромбопластина [4], то она должна отразиться и на величине МНО. В 1998 году Chantarangkul et al.[3] проведено многоцентровое исследование, целью которого была оценка влияния концентрации цитрата, взятого для стабилизации крови, на величину МНО. В ходе исследования тромбопластины калибровали по МИЧ на плазмах крови, взятой со 105 мМ цитратом натрия, а для последующего анализа МНО кумариновые плазмы крови стабилизировали 129 мМ цитратом, и наоборот. Анализировали две крайние величины терапевтического диапазона МНО — 1,5 и 4,5 (значения были предварительно определены в соответствии с требованиями ВОЗ, то есть ручной техникой, с использованием международного референсного препарата тромбопластина и 109 мМ цитрата в качестве стабилизатора крови). Концентрация цитрата влияла на величину отклонения МНО от рассчитанных значений. Отклонение МНО при значении 1,5 было незначительно (1,4—1,6, то есть –4% и +5%), однако отклонение от значения 4,5 составило –15% и +20%, то есть МНО колебалось от 3,8 до 5,4. Последнее, безусловно, важно для клинического ведения пациента. В следующей серии исследования [3] авторы определяли, насколько отклонится рассчитанное значение МНО от величины 4,5 в следующих экспериментальных условиях: МИЧ тромбопластина калибровали вручную на плазмах крови, стабилизированных 105 мМ цитратом, затем с этим тромбопластином ставили ПТ, собирая кровь в 129 мМ цитрат и работая на коагулометре. На коагулометре ACL 300R (Instrumentation laboratory, США) разница составила 64%, то есть рассчитанное МНО оказалось 7,4 (вместо 4,5), и это уже дает основание для принятия решения врачом о коррекции дозы ОА.
Все вышесказанное убеждает в необходимости использования одной (109 мМ) концентрации цитрата для всех целей: сбора плазм крови в лабораториях, приготовления лиофилизированных плазм для систем внешнего контроля качества и локальной калибровки тромбопластина.
Система локальной калибровки (СЛК) тромбопластина и коагулометра с помощью лиофилизированных плазм с сертифицированным МНО.
Альтернативный системе МНО/МИЧ подход к стандартизации ПТ заключается в использовании серии калиброванных по МНО плазм [10]. Эта концепция была предложена Houbouyan et al. в 1993 году [6]. Математическое преобразование формулы (1) приводит к следующему уравнению:
Log (ПВпациента)= 1/МИЧ х Log (МНО) + Log(СНПВ) (2)
Для построения МНО-калибровочного графика используют двойную логарифмическую шкалу: по оси абсцисс наносят величины МНО плазм-калибраторов (сертифицированные фирмой-производителем), по оси ординат — ПВ этих плазм, определенные в лаборатории. МНО плазмы пациента вычисляют по графику, исходя из линейной зависимости ПВ и МНО согласно формуле (2). Преимуществом СЛК является, во-первых, ее простота и, во-вторых, исчезновение таких источников вариабельности МНО как МИЧ тромбопластина (документированы случаи его некорректного определения фирмами-производителями [11]) и СНПВ.
СЛК была сравнена с системой МНО/МИЧ в исследовании Houbouyan et.al., проведенном в рамках французской программы внешнего контроля качества [7]. Показано существенное снижение межлабораторной вариабельности МНО исследуемых плазм при работе в СЛК по сравнению с системой МНО/МИЧ (коэффициенты вариации 12,5 и 18,5 %, соответственно).
Таким образом, оптимизация терапии ОА напрямую связана с пониманием сотрудниками лаборатории и клиницистами сути стандартизации ПТ и строгим соблюдением рекомендаций ВОЗ. Клинико-диагностические лаборатории, работающие в системе МНО/МИЧ, должны требовать от фирм-производителей тромбопластина коагулометр-специфичного МИЧ и вычислять СНПВ не менее 20 свежих плазм здоровых людей для каждой серии тромбопластина. Хотя СЛК пока не утверждена на международном уровне, мы считаем возможным рекомендовать ее как основную для российских клинико-диагностических лабораторий из-за простоты и отсутствия основных источников вариабельности МНО. При этом следует лишь строго придерживаться рекомендованной ВОЗ концентрации цитрата для сбора плазм.
Список литературы
1. Лечение оральными антикоагулянтами. Рекомендации Всероссийской ассоциации по изучению тромбозов, геморрагий и патологии сосудов имени А.А. Шмидта-Б.А. Кудряшова, Москва, 2003.
2. Baglin T. Decentralized anticoagulant care. J. Clin. Path., 1998, 51, 89-91.
3. Chantarangkul V., Tripodi A., Clerici M., et al. Assessment of the influence of citrate concentration on the International Normalized Ratio (INR) determined with twelve reagent-instrument combination. Thromb. Haemostas., 1998, 80, 2, 258-262.
4. Duncan E.M., Casey S.R., Duncan B.M., et al. Effect of concentration of trisodium citrate anticoagulant on calculation of the international normalized ratio and the international sensitivity index of thromboplastin. Thromb. Haemostas., 1994, 72, 1, 84-88.
5. Hirsh J., Dalen J.E., Anderson D.L., et al. Oral anticoagulants: mechanism of action, clinical effectiveness, and optimal therapeutic range. ≥Chest, 2001, 119, S8 - S21.
6. Houbouyan L.L., Goguel A.F. Procedure of reference calibrated plasmas for prothrombin time stsndardization: data from French interlaboratory surveys. Poster, XIVth Congress of the International Society on Thrombosis and Haemostasis, 1993, 69,6, 663.
7. Houbouyan L.L., Goguel A.F. Long-term French experience in INR standardization by a procedure using plasma calibrants. Am. J. Clin. Pathol., 1997, 108,1, 83-89.
8. Kitchen S., Preston E. Standardization of prothrombin time for laboratory control of oral anticoagulant therapy. Sem. Thromb. Haemostas., 1999, 25,1, 17-25.
9. Lang H., Spaethe R., Beeser H., et.al. Сalibration of lyophilized pooled plasma as a candidate reference plasma for standardization of the prothrombin time ratio. Hamostaseologie, 1993, 13, 96-105.
10. Moritz B., Lang H. Use of plasmas from donors on oral anticoagulant treatment for the expression of International Normalized Ratio (INR) values. Lecture Second Intern. Winter Meeting on Coagulation, 1996, 293.
11. O’Brien W.F., Crawford L., Wood D.E. Discrepant results in INR testing. Thromb. Haemostas., 1994, 72, 6, 986-987.
12. Palkuti H. International normalized ratio (INR). Clinical significance and applications. Bio/Data Corporation, 1995.
13. Poggio M., Van den Besselaar AMHP., Van der Velde E.A., et al. The effects of some instruments for PT testing on the ISI of two rabbit brain thromboplastin reagents. Thromb. Haemostas., 1989, 62, 3, 868-874.
14. Poller L., Keown M., Shepherd S.A., et.al. The effect of freeze drying and freeze drying additives on the prothrombin time and the international sensitivity index. J. Clin. Pathol., 1999, 52, 744-748.
15. Quick A. The prothrombin time in hemophilia and jaundice. J. Biol. Chem., 1935, 109, 73-74.
16. Van den Besselaar AMHP, Evatt B.l., Brogan D.R., et al. Proficiency testing and standardization of prothrombin time: effects of thromboplastins, instrumentation and plasma. Am.J.Clin.Path., 1984, 82, 6, 688-699.
17. WHO expert committee on biological standardization. Thirty Third report. WHO Technol. Rep. Series, 1983, 687, 81-105.
18. WHO expert committee on biological standardization. WHO Technical Rep. Series. Guidelines for thromboplastins and plasma used to control oral anticoagulant therapy, annex 3, 1999, 889, 64-93.
|
автор: Т.Н. Дугина, А.Б. Косырев ООО «НПО «Медио Лаб», Москва год издания: 2003 |
|