 |
Российская Ассоциация
(РАМЛД) |
г.Москва, 119526, а/я 117, РАМЛД,
т/ф.: (495) 433-24-04
|
автор: Е.Б. Владимирская НИИ детской гематологии, Москва год издания: 2002 |
Механизмы действия ростовых факторов
Гемопоэтические ростовые факторы регулируют выживание и пролиферацию ранних предшественников, дифференцировку коммитированных и функциональную активность зрелых клеток. В настоящее время все активно действующие факторы, производимые клетками, включая и ростовые факторы, получили название «цитокинов». В обзоре литературы представлены сведения о свойствах, происхождении и функциях основных цитокинов, регулирующих кроветворение и иммуногенез, указаны клеточные мишени их действия.
Гемопоэтические ростовые факторы регулируют выживание и пролиферацию ранних предшественников, дифференцировку коммитированных и функциональную активность зрелых клеток. Их объединяют следующие общие свойства:
• они являются гликопротеинами;
• активны in vivo и ex vivo;
• продуцируются различными клетками;
• имеют специфические функции и в то же время действуют на общие мишени;
• обнаруживают синергизм и аддитивный эффект по отношению к другим ростовым факторам;
• биологическое действие реализуют через связывание со специфическими рецепторами.
В настоящее время все активно действующие факторы, производимые клетками, включая и ростовые факторы, получили название «цитокинов».
Термин «лимфокины» сохранился за цитокинами лимфоидного происхождения, «монокины» — за производными моноцитов. Для унификации обозначения факторов, имеющих часто много названий в соответствии с разнообразными функциями в разных биологических системах, с 1979 года используется термин «интерлейкин» (IL) — взаимодействие между лейкоцитами [5]. Так, IL-1 описывался ранее как лимфоцит-активированный фактор (LAF), митогенный протеин (MP), Т-замещающий фактор III (TRF-III) , фактор В-клеточной активации(BAF) и фактор, дифференцирующий В-лимфоциты (BDF). IL-2 известен также как ростовый фактор Т-лимфоцитов (TCGF) и в то же время тимоцитарный митогенный фактор (TMF).
Первая классификация интерлейкинов была предложена Международным Союзом Иммунологических обществ (МСИО) в 1992 году [8], в нее вошло 10 интерлейкинов и некоторое число цитокинов, сохранивших прежние названия, связанные с их основной активностью. В последующие годы произошло значительное расширение этого списка. В
табл. 1 представлены основные цитокины, регулирующие кроветворение и иммуногенез, указаны клеточные мишени их действия. Следует, однако, помнить, что свойства их вариабельны, т.к стимуляция клетки одним цитокином вызывает в ней каскадную активацию рецепторов к другим, в обычном состоянии не экспрессированным на клетке.Таблица 1.
Гемопоэтические ростовые факторы и мишени для их действия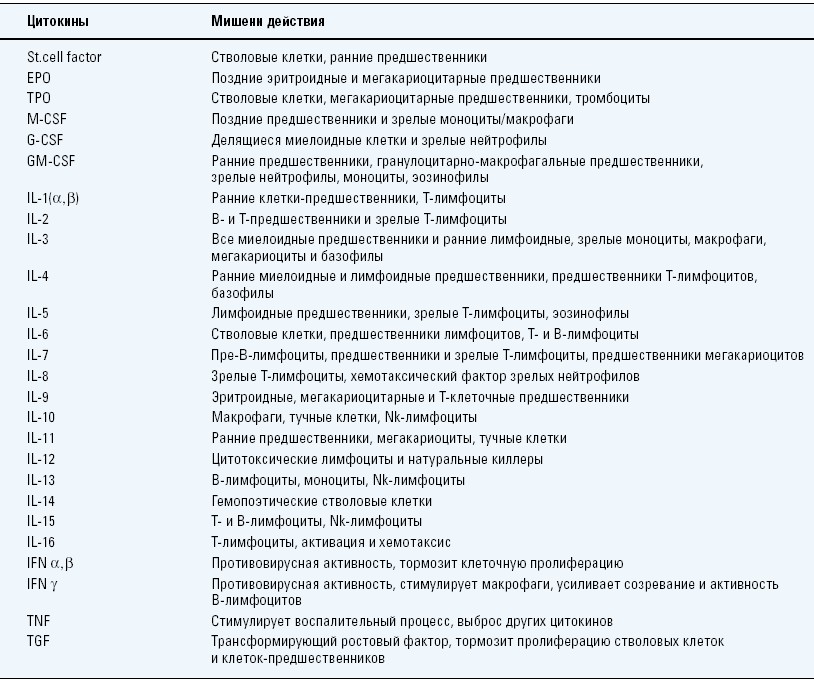
Происхождение и функция цитокинов
Достижения молекулярной биологии и генетики последнего десятилетия позволили получить практически все цитокины рекомбинантным путем, выявить их структуру и генетическое происхождение. В табл. 2 приведены клеточные источники основных цитокинов, вовлеченных в регуляцию кроветворения и иммуногенеза. Однако в отношении функциональной активности цитокинов многое остается неясным: одни и те же цитокины необходимы для пролиферации, дифференцировки и функциональной активности клеток крови и иммунной системы разных уровней созревания и направлений дифференцировки, в то же время для полноценной жизнедеятельности каждой клеточной генерации необходимо сочетанное воздействие различных цитокинов.
Таблица 2.
Клеточные источники цитокинов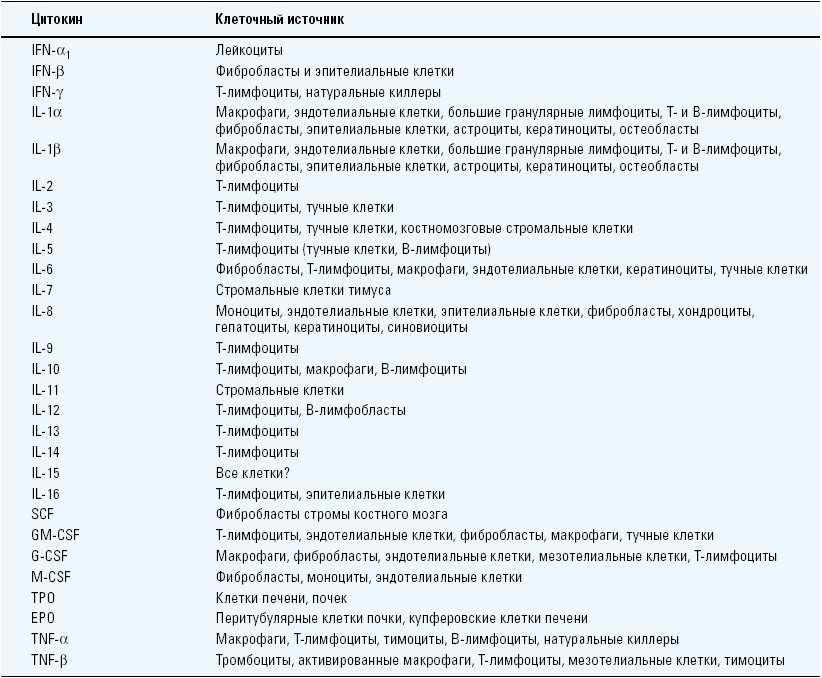
Чем глубже изучается тот или иной цитокин, тем труднее уложить его в прокрустово ложе какой либо одной классификации. В качестве примера можно привести IL-1 [4]. Будучи, в основном, провоспалительным цитокином и медиатором лихорадки, IL-1 проявляет и другие виды биологической активности: является кофактором активации Т-лимфоцитов и В-лимфоцитов; служит промотором гемопоэза и в то же время рассасывания хряща кости; активирует функцию нейтрофилов и эндотелиальных клеток сосудов, пролиферацию фибробластов; идуцирует высвобождение белков острой фазы, протеолиз мышечных клеток. И это еще далеко не полный перечень функций только этого цитокина. Клетки воспринимают цитокиновые сигналы через специфические рецепторы. В структуре и функции этих рецепторов, а также в особенностях внутриклеточной передачи цитокиновых сигналов и следует, по-видимому, искать объяснения особенностей и механизма действия цитокинов.
Передача цитокинового сигнала
Среди множества сигнальных внутриклеточных белков у гемопоэтических клеток особенно важными являются молекулы, объединенные общим названием Stat (sygnal transductors and activators of transcriptions) — факторы, передающие сигнал в ядро клеток и активирующие транскрипцию генов. Эти молекулы, содержащие SH2 домены, находятся в клетках в неактивном состоянии. Тирозиновые основания внутриклеточного цитокинового рецептора, активированные фосфорилированием, привлекают к себе неактивные Stat's c SH2 доменами. Тирозин-киназы, связанные с рецептором (Jak's и др.), активируют Stat's путем фосфорилирования, вызывая их димеризацию. Активированные Stat's отходят от рецептора, проникают в ядро, связываются со специфическими элементами ДНК и вызывают их транскрипцию. Схематически это представлено на рис. 1.
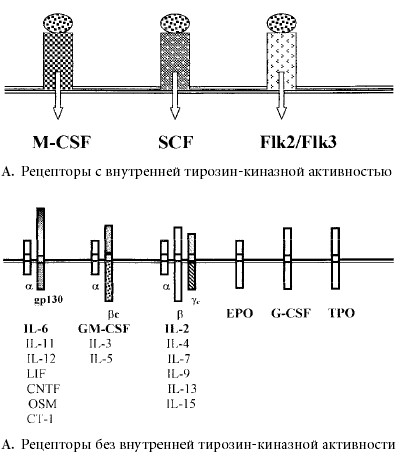
Рис. 1
. Виды рецепторов гемопоэтических ростовых факторов. Объяснения в текстеСуществует 7 различных форм Stat, избирательно связывающихся с тирозиновыми основаниями цитокиновых рецепторов, каждая из них имеет и свои преимущественные пути тирозин-киназной активации. Возможно, от того, какая форма Stat подвергается активации, в значительной мере зависит и различная реализация цитокинового сигнала (пролиферация, дифференцировка, апоптоз, выживание и др.) [11]. Есть достаточно оснований считать [3], что избирательная генерация цитокинового сигнала связана с функцией активированных тирозиновых оснований. При этом у большинства цитокинов пролиферативные сигналы генерируются в проксимальной части внутриклеточной сигнальной цепи рецептора, сигналы на дифференцировку — в средней части, а регуляция апоптоза связана с дистальным участком рецепторной цепи.
Негативным регулятором основного, тирозинкиназного, пути передачи сигналов являются тирозиновые фосфатазы, которые активируются в процессе тирозинового фосфорилирования самим цитокиновым рецептором, являясь его структурной частью, и необходимы для прекращения сигнала. Основной функцией этих гемопоэтических клеточных фосфатаз (HCP) является инактивация Jak’s, ведущая к прекращению цитокинового сигнала[2]. В клетках крови и иммунной системы существуют и другие, не тирозин-киназные пути формирования и передачи цитокиновых сигналов. Активация многих цитокиновых рецепторов связана с экспрессией эффекторного белка RAS-онкогена (р21 или RAF), что ведет, в свою очередь, к активации протеиновых и серин/треониновых киназ, объединенных в общую группу, известную под названием «протеин-киназа С» (PKC) [7, 10]. Эти киназы способны взаимодействовать с тирозин-киназами, модулируя их активность, и самостоятельно фосфорилировать другие транскрипционные факторы, том числе и эффекторные домены некоторых цитокиновых рецепторов, не относящихся к семье тирозин-киназных рецепторов (например, IL-1-R, TGFR, и др.) [4]. Эти же механизмы играют существенную роль и в передаче проапоптотических сигналов от рецепторов региона «клеточной смерти» (FAS-R, TNF-R). Путем протеин-киназного фосфорилирования реализуется большинство дифференцирующих сигналов, а также митогенные и антиапоптотические сигналы, независимые от тирозин-киназного механизма. Такой способ контроля механизмов апоптоза особенно выражен у миело-моноцитарных клеток.
Механизмы реализации регулирующей роли цитокинов в кроветворении
Анализируя накопившиеся к настоящему времени сведения о формировании и проведении цитокиновых сигналов в кроветворных клетках, можно сделать следующие обобщения:•
Для активации рецептора ростовых факторов и проведения цитокинового сигнала используются внутриклеточные факторы, набор которых генетически детерминирован для каждого вида клеток и на каждом уровне клеточной дифференцировки.•
Внутриклеточные молекулы, необходимые для проведения цитокиновых сигналов, находятся в клетке в неактивном состоянии; инструментом их активации является фосфорилирование, представляющее собою сложную многовариантную цепочку, включающуюся активацией рецепторов цитокинов.•
Выбор пути проведения цитокинового сигнала и характера его конечной реализации (пролиферация, дифференцировка, апоптоз и др.) зависят от 2 групп факторов: структуры и характера активации рецептора, с одной стороны, и особенностей метаболизма клетки-мишени, с другой.Наличие общих внутриклеточных цепей у рецепторов различных цитокинов подчеркивает важность для клетки реализации тех программ, которые инициируют эти цепи при активации. Эти программы настолько важны для жизни клеток, что возможность их включения различными цитокинами можно рассматривать как некий запас прочности и стабильности связи клеток с микроокружением, без которого они не могут существовать. Чем больше рецепторов разных видов имеет кроветворная клетка, тем шире у нее спектр жизненно важных программ, возможных для осуществления. Можно предположить, что именно поэтому у стволовых кроветворных клеток и ранних клеток-предшественников обнаруживается высокая плотность рецепторов всех классов цитокинов. Отсюда, так называемую, «стохастичность» их клеточной дифференцировки можно рассматривать как результат многофакторного, непредсказуемого для нас, взаимодействия рецепторных возможностей и метаболических особенностей клетки. С этой точки зрения, представляется интересной гипотеза D.G. Tenen [9, 12], по которой действие на стволовую клетку ростового фактора направленного действия, например, GM-CSF, вызывает в ней активацию транскрипционного фактора миелоидной дифференцировки (PU1) с подавлением всех других транскрипционных факторов. Этот транскрипционный фактор активирует ген GM-CSF-R
α, что определяет в дальнейшем движение клетки по миелоидному пути.С этих позиций аддитивный эффект цитокинов в кроветворении обеспечивается экспрессией большого числа рецепторов, что можно рассматривать как предоставление клетке оптимальных условий для реализации заложенных в ней возможностей. Известно, что стимуляция одним ростовым фактором вызывает в клетке каскадную экспрессию рецепторов к другим цитокинам. Так, например, при стимуляции ex vivo миелоидных предшественников IL-3 или GM-CSF клетки начинают экспрессировать рецепторы к G-CSF, плотность которых на поверхности неактивированных предшественников чрезвычайно низка [6].
При этом следует отметить, что действие цитокинов является лишь необходимым стимулом для реализации тех программ в клетках, которые генетически предопределены линией дифференцировки и стадией созревания. Так, если имплантировать рецептор эритропоэтина в макрофагальные предшественники, а рецептор M-CSF — в эритроидные предшественники, то эритропоэтин будет стимулировать развитие макрофагальных колоний, а М-CSF — эритроидных [1].
Представляется интересным проанализировать также и механизм плейотропного действия цитокинов. Такую активность демонстрирует, например, GM-CSF, который оказывает митогенный эффект на уровне пролиферирующих миелоидных клеток и в то же время способствует фагоцитозу зрелых гранулоцитов. Другой пример — IL-5, необходимый для дифференцировки как Т-лимфоцитов, так и эозинофилов.
Для объяснения плейотропности цитокинов в кроветворении могут быть рассмотрены следующие возможные механизмы:
• Клетки разных уровней и направлений дифференцировки могут иметь различные пути для проведения одних и тех же цитокиновых сигналов, что и вызывает их различную конечную реализацию.
• Одни и те же сигнальные пути могут быть реализованы по-разному вследствие влияния на них различных молекул-активаторов и молекул-супрессоров (например, НСР) проведения сигналов. К тому же у клеток может быть разный набор генов-мишеней, способных к активации цитокиновым сигналом.
• Цитокиновый рецептор может одновременно индуцировать противоположные по своей конечной реализации сигнальные пути по крайней мере в некоторых клетках. Их баланс и взаимодействие определяют конечный ответ. Так, TNF одновременно индуцирует проапоптотический сигнал через каспазный каскад и антиапоптический, воспалительный сигнал через активацию NF-kappa B. Результат зависит от взаимодействия этих путей.
Итак, реализация цитокиновых воздействий на клетку — результат многовариантных взаимодействий различных внутриклеточных факторов. Среди этих факторов следует учитывать длительность пребывания отдельных сигнальных молекул в активном состоянии, наличие негативных и позитивных регуляторов сигнальной трансдукции, взаимодействие отдельных сигнальных молекул между собой и способность клетки на генетическом уровне экспрессировать те или иные свойства.
Таким образом, цитокиновую регуляцию кроветворения можно рассматривать как механизм связи клеток крови с окружающей средой. Цитокиновый сигнал необходим для жизнедеятельности клетки. Однако характер ответа на него зависит от самих клеток: экспрессии цитокиновых рецепторов, особенностей формирования и проведения цитокиновых сигналов и генетических возможностей клетки.
Литература
1. Владимирская Е.Б.,Румянцев А.Г...Гематол. и трансфузиол. // 1991, 1, 8-12.
2. Владимирская Е.Б., Масчан А.А.,Румянцев А.Г.//Гематология и трансфузиология, 1997, 5, 4-9
3. Brandt J.E., e.a. // Dlood, 1994, 83, 1507-1511
4. Burton E.A.,Hunter S.,e.a. // J. Biol. Chem., 1997, 272, 16189-95
5. Dinarello Ch.//Cytokine and Growth Factor Rev., 1998, 353-265
6. Hoffman B.,Lieberman D.//Oncogine,1994, 9, 1807-1811
7. Hu X., Zuckerman K.//Leukemia and Lymphoma, 2000, 38, 235-246
8. Johnson L.N.,Noble M.,Owen D.//Ctll,1996,85,149-158
9. McCubrey J.A., Stratford May W., e.a. // Leukemia, 2000, 14, 9-21
10. Ray C.A.,Black R.A., e.a. // Cell, 1992, 69, 597-604
11. Rodel J.E., Link D.C .// Blood, 1996, 87, 858-861
12. Thompson C.,Gajewsky T. // Cell, 1996, 87, 587-592
|
автор: Е.Б. Владимирская НИИ детской гематологии, Москва год издания: 2002 |
|



